|
NAUČNI TEKSTOVI:
-
ISTORIJAT PRONALASKA PEPTIDA, KRAJ XIX VEKA
– SREDINA XX VEKA
- PEPTIDI I SUŠTINA PEPTIDNE BIOREGULACIJE
- PEPTIDNI BIOREGULATORI
- MODEL
INTERAKCIJE KRATKIH PEPTIDA SA DVOSTRUKOM SPIRALOM DNK
- TAJNA
ŽIVOTA – NANOPEPTID
- ZNACI
STARENJA ORGANIZMA
ISTORIJAT PRONALASKA PEPTIDA, KRAJ XIX VEKA
– SREDINA XX VEKA
Stolećima
unazad je enigma strukture i funkcije živoga organizma bio izazov
za naučnike koji su pokušavali da odgonetnu koje bi lekovite supstance
mogle da normalizuju ne samo prirodne funkcije organa, već i da
pomognu u detoksikaciji organizma.
Napor
biologa i naučnika je postepeno, korak po korak, rezultirao proučavanjem
do molekularnog nivoa najvažnijih osnovnih strukturnih komponeti
organa i sistema. Tako su u jedinjenjima dobijenih hidrolizom belančevina,
najvažnijih strukturnih elemenata ljudskog organizma, otkrivene
aminokiseline (1900 godine je pronađeno samo 13), sve ostalo je
nazvano, "peptoni", čija svojstva nisu mogla biti proučavana
i koji nisu mogli biti ni istraživani zbog tadašnjeg stepena razvoja
nauke.
Ali,
nauka se kao i život na Zemlji stalno kretala napred, pa je i teorija
E. Fišera o građi humanih belančevina objasnila i funkciju i postojanje
ćelijskih aminokiselina. Osnova za ovu teoriju su bila kompleksna
istraživanja belančevina (proteina). Fokus ovih istraživanja je
upravo bila sinteza aminokiselina i peptida, odnosno njihova sinteza
i očuvanju ne samo njihove strukture već i funkcionalnih svojstava.
E.Fišer je istražujući pisao o tome da je bez obzira na ogromne
teškoće, neophodno tragati ka sintezi jedinjenja i molekula aminokiselina
koji će uneti u organizam dati pozitivne zdravstvene efekte.
Treba
naglasiti da je njegova teorija, neosporno dokazana, a sinteza belančevina
(peptida) u obliku ćelijskih aminokiselina do danas osnova za mnoge
naučne radove, istraživanja i otkrića, doduše mnogo kasnije, jer
se pionirski poduhvati najčešće ocenjuju negativno od strane savremenika.
Saradnici
E.Fišera su sintetisalii više od 125 peptida (ćelijskih aminokiselina)
koji su imali različitu građu i dejstvo. Najveći peptid je imao
u sebi 18 segmenata aminokiselina.
Posle
mnogih dodatnih istraživnja, dijametralno različitih, u drugoj polovini
XX veka dokazano je ipak da je teorija E.Fišera neoboriva i dalja
istraživanja su usmerena u pravcu proučavanja belančevina, njihovog
usavršavanja na osnovu dobijenih podataka i primene u kliničkoj
praksi.
Istorija
pronalaska peptida krajem XX – početak XXI veka na Institutu za
bioregulaciju i gerontologiju u Sankt Petersburgu, severo-zapadnog
ogranka Ruske akademije nauka i medicine.
70-tih
godina XX veka, na Vojno Medicinskoj akademiji Kirov u Sankt Piterburgu
pod rukovodstvom profesora V.H.Havinsona počela su eksperimentalna
animalna istraživanja na sintezi kratkih peptida iz različitih tkiva
i organa i njihov uticaj nakon unošenja, na organizam čoveka. Produžavajući
istrazivanja V.H.Havinson i saradnici su zaključili da peptidi pokazuju
ne samo pozitivan fiziološki efekat na organe čoveka već i indukuju
spontanu sintezu proteinskih struktura u njima i time direktno uspostavljaju
sve vitalne funkcije organizma na najoptimalniji nivo. Definitivno
je zaključeno i dokazano da je najefikasnije primeniti organ-specifične
peptide, odnosno one koji prirodno čine strukturu određene ćelije
u organu.
Do
danas je tim pod rukovodstvom akademika, člana Ruske akademije za
medicinske nauke, profesora V.H.Havinsona razvio i registrovao više
od 40 peptidnih bioregulatora, a u procesu registracije kao lekova
su dva preparata kratkih peptida (Bronhogen forte i Pankragen forte),
dok su drugi preparati u pripremi za ovaj proces. Preparati ove
kompanije su patentno zaštićeni u 13 zemalja uključujući i SAD.
<
NA VRH >
PEPTIDI I SUŠTINA PEPTIDNE BIOREGULACIJE
 |
Peptidi
igraju centralnu ulogu u fiziološkim procesima u telu. I što
je najvažnije, peptidi regulišu delovanje (aktivnost) gena,
jer su nosilac jedinstvenog koda informacija za strogo definisane
vrste ćelija.
Peptidi su supstance u čije molekule su ugrađeni lanci sa
više amino kiselina, povezane međusobno peptidnim vezama.
Naši
životi postoje zbog dva molekula: proteina - peptida, i DNK,
koji čuvaju informacije. Ali, DNK je matrica, hemijski molekul,
koji sam po sebi nije aktivan. Spajanje peptida sa određenim
delom DNK, kao ključ sa bravom, je komandni signal za sintezu
zadanih osobina. |
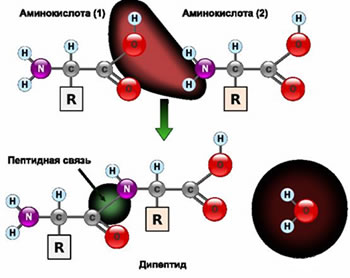
Najjednostavnija
struktura proteina formirana je peptidanim vezama. Amino kiseline
u peptidima međusobno su povezane običnim kovalentnim vezama, koje
mogu biti uništene samo u teškim uslovima (na primer, pri kuvanju
jaja dolazi do hidrolize peptida i izdvajanja proteina).
Sinteza
proteina, odnosno realizacija genetskih informacija u živim celijama
ostvaruje se pomoću dva matrična procesa: transkripcijom (tj. sinteza
mRNK na matrice DNK) i translacijom genetskog koda i povezivanje
sa aminokiselinama.
Ako predstavimo ljudsku fiziologiju kao lutkarsko pozorište, onda
transkripcioni faktori rade u njemu nitima, spajajući ruke glumca
sa lutkama. Kontrola pravilnog rada transkripcionih faktora je ključ,
ne samo u bori protiv raznih bolesti, već i u tehnologiji matičnih
ćelija. Međutim, ovi proteini do nedavno su se smatrali neosetljivi
na lekove: supstance koje kontrolišu njihove aktivnosti nisu postojale.
Ni konvencionalni lekovi (koji se sastoje od "malih" molekula),
niti beoklv (koji se sastoji od makromalekula), preparati na koje
nisu imali uticaja.
Transkripcione
veze ne rade same, već u kombinaciji sa drugim proteinima. Naučnici
su otkrili da veze proteina imaju poseban spiralni oblik. Oni su
predložili, da ako je konstruisani red spirala sličan ovom u "vezi"
po veličini, to jedna od njih, po mogućnosti, može biti ugrađena
u stanje strukturu kompleksa i da promene aktivnost gena u DNK.
Naučnici
su eksperimentalno utvrdili da peptidi regulišu aktivnost gena putem
komplementarnog vezivanja sa odredenim delom DNK, odnosno sa genospecifičnim
vezama i direktno su uključeni u mehanizme epigenske regulacije.
Peptidi u tako "utvrđenom položaju" prenose informacije
strogo određenom tipu ćelija (sinteza specifičnih tkivnih proteina).
A to znači da određeni peptid deluje na strogo definisani tip tkiva
ili organa.
Mehanizam peptidne regulacije žive materije može se svesti na sledeće
faze:
- Komplementarna interakcija kratkih peptida sa DNK,
- Promene u usaglašenosti i dejstvu (aktivnosti) gena,
- Sinteza specifičnih tkivnih proteina,
- Regulacija biohemijskih i fizioloških procesa.
 |
Sumirajuci
navedeno, napominjemo da peptidi utiču na organizam tako što
pokreću proces podmlađivanja i obnove ćelija.
Peptidi, i prirodni (dobijeni ekstrakcijom iz jednog organa)
i sintetički imaju zaštitni efekat na organizam na ćelijskom
nivou. Peptidi štite ćelije od izlaganja toksinima, ubrzavaju
metabolizam u celijama i uklanjaju iz njih otpadne materije,
ali generalno, peptidi normalizuju rad organa, doprinose zasićenju
hranljivim sastojcima, kao i obnovu oštećenih tkiva. |
<
NA VRH >
PEPTIDNI BIOREGULATORI
Život
savremenog čovečanstva je ispunjen ogromnim pritiscima na ljudski
organizam. Stres, narušena ekologija, nedovoljno kretanje - sve
to dovodi do funkcionalnih poremećaja organizma, teorije starenja
neosporno dokazuju da je bazični proces sterenja organizma na ćelijskom
nivou i upravo zbog toga i "pomoć" organu mora biti na
istom nivou – mikroskopskim gradivnim jedinicama ćelije zajedničkim
za žive organizame genaralno.
 |
Mada
se do skora mislilo da je mladost nešto što brzo prolazi u nepovrat,
danas se zna, zahvaljujući 30-godišnjim istraživanjima procesa
starenja ruskih naučnika da su se pojavile unikatne komponentne
- peptidni bioregulatori, koji delujući na osnovnu strukturu
ćelije organizma sprečavaju razvoj bolesti, ali se i suprostavljaju
progresivnim biološki uslovljenim obolenjima, čuvajući mladost
i funkcionalnost svake žive celije organizma, a samim tim i
organizma u celini. |
Proučavanjem
strukture najaktivnijih kombinacija aminokiselina (peptida) različitih
organa, u laboratorijskim uslovima su stvorena anologna jedinjenja.
Uneti u organizam čoveka peptidi mogu produžiti za 30-40% život
ćelije tog organa iz koga su stvoreni (tkivno-specifično dejstvo
i struktura).
Mehanizam
dejstva kompleksa peptida može se objasniti na način da oni revitalizujući
ćeliju, podmlađuju kompletno čitav organizam, imaju protektivno
dejstvo jer povećavaju otpornost ćelije od hipoksije i dejstva toksina,
normalizuju razmenu materija u tkivima, inteziviraju metablizam
na ćelijskom nivou. Peptidi imaju protektivno i revitalizirajuće
dejstvo na tkiva i organe kako u normalnim, fiziološkim uslovima,
tako i u patološkim uslovima, pošto održavaju na fiziološkom nivou
broj zrelih, funkcionalno aktivnih ćelija, kao i razmenu materija
u njima. Ovim dejstvom peptidi optimizuju fiziološke procese organa
i tkiva.
Peptidi
su organske supstance koje se sastoje iz aminokiselina sjedinjenih
peptidnom vezom, kao bi-, tri, tetrapeptidi ali i polipeptidi. U
ćelijama živog organizma peptidi se sintetišu iz aminokiselina ili
se javljaju kao rezultat razmene materija belančevina. Mnogi prirodni
peptidi imaju biološki aktivna svojstva (npr. glutation, glukagon,
gramicidin).
Peptidni
bioregulatori su kratki lanci aminokiselina, prvobitno izdvojeni
iz organa i tkiva životinja, a potom sintetisani u laboratorijskim
uslovima. Oni imaju sposobnost da regenerišu tkiva i organe, ustanovljavajući
ponovo funkciju koju su narušili patološki procesi. Narušavanje
bioregulacije na celijskom nivou, dovodi do smanjenja otpornosti
organizma prema faktorima spoljne sredine i homeostaze ćelije, što
je jedan od uzroka starenja organizma. Peptidni bioregulatori normalizuju
sintezu belančevina, tako što sprečavaju sukcesivne degenerativne
promene karakteristične za starenje i kanališu promenu zdravog ljudskog
organizma ka procesima revitalizacije.
Peptidni
bioregulatori se primenjuju profilakticki i u terapiji sindroma
povezanih sa biološkim starenjem organizma i značajno povećavaju
efektivnost određenih procedura rehabilitacije posle dejstva raznih
ekstremnih stresogenih faktora kao što su trauma, radijacija, intoksikacija,
infekcija, psiho-fizicki napori i dr.
Peptidi
kao i belančevine, sastoje se iz ostataka aminokiselina, povezanih
peptidnim vezama, a po hemijskom sastavu ni u čemu se ne razlikuju
od belančevina same strukture ćelije. Ipak razlike među njima postoje
u strukturi i pre svega u dužini polipeptidnog lanca. Peptidi imaju
kraće lance - približno granica između peptida i belančevina se
nalazi u okviru 50 aminokiselinskih ostataka.
To
je najvažnija specificnost svih belančevina. Zato peptidi, za razliku
od belančevina ne podležu denaturaciji odnosno ireverzibilnoj promeni
prirodne konfiguracije pod dejstvom ekstremnih uticaja na ćeliju.
Dejstvo peptida na organizam može se opisati na sledeći način –
peptidi revitalizuju tj. "podmlađuju" ćelije ljudskog
organizma u celini, imaju protektivni efekat, povećavaju otpornost
ćelije prema hipoksiji, ubrzavaju metaboličke procese i iskoristljivost
nutritivnih metabolita neophodnih za ćelijsku homeostazu i održavaju
na fiziološkom nivou broj zrelih, funkcionalno aktivnih ćelija čime
optimizuju fiziološke procese organa i tkiva.
MODEL INTERAKCIJE KRATKIH PEPTIDA
SA DVOSTRUKOM SPIRALOM DNK
Poređenje prostornog uređenja funkcionalnih
grupa nukleotidnih osnova (baza) na površini velikog kanala dvojne
spirale DNK i funkcionalnih grupa kratkih peptida ukazuje na to,
da ove poliamfolitne strukture imaju mogućnost višestruke dopunske
interakcije (uzajamnog dejstva). Kao primer, dat je model dopunske
veze sintetičkog tetrapeptida epifize Ala-Glu-Asp-Gly sa nizom nukleotida
ATTTS u vodeći lanac dvojne spirale DNK, koje se ponavlja na početnim
delovima gena telomeraze i RNK polimeraze II. Pokazano je da regulatorni
peptidi i njihove dopunske jedinice u dvostrukoj spirali DNK mogu
biti povezane sa proton-donatorom i proton-akceptorom koji su u
interakciji, s učešćem molekula hidratacione vode.
Poznato je da normalne ćelije reaguju
na spoljne ili unutrašnje promene u intenzitetu promena transkripcije
(prenošenje sa jednog na drugi) aktivnih gena i sinteze RNK. Jedan
od faktora patološkog stanja tela usporava te procese, a posebno,
poremećaj procesa inicijacije transkripcije. U isto vreme, utvrđeno
je, da su neki proteini, koji kontrolišu ćelijski ciklus, bili aktivni
kao faktori transkripcije. Pitanje mehanizma inicijacije transkripcije
rešava se proučavanjem strukture transkripcionih faktora i određivanje
njihovih obavezujućih lokacija sa dvostrukom spiralom DNK na početnom
(nekodiranom) delu gena. Od pojave prvih studija iz ove oblasti
u ranim 80. pronađeni su zajednicki strukturni motivi u strukturi
transkripcionih faktora nekih gena i njihovih kompleksa sa određenim
povezanošću nukleidnih parova u dvostrukoj spirali DNK početnih
delova gena. Otkriveno je, da se ćelijska aktivacija hromatina i
kontrola transkripcije sprovodi složenim sistemom transkripcionih
faktora i agonista, uključujući i visoko-molekularne proteine, kao
i malo-molekularne peptide i kratke peptide.
Tada se činilo, da je specifična
aktivnost mnogih visokomolekularnih transkripcionih faktora lokalizovana
na relativno kratkom delovima peptidnog lanca koji se sastoji od
30-100 aminokiselinskih ostataka. Ova zapažanja su identifikovala
novi problem farmakologije i medicine. Trebalo je utvrdi, koja minimalna
dužina i aminokiselinski ostatak kratkih peptida, direktno i selektivno
kontaktiratira sa početnim delom gena i koji je u stanju da imitira
dejstvo faktora transkripcije. Više detalja molekularnih mehanizama
transkripcije u ćelijama dat je u literaturi.
Uobičajeni pristup za određivanje
lokacije povezivanja u strukturi proteina je korišćenje imunospecifičnih
metoda. Na primer, bio je definisan V-lanac laminina, koji se sastoji
od 14 aminokiselinskih ostataka, koji je odgovoran za atheziju epitelnih
ćelija. Dalja istraživanja su pokazala da ovaj peptid može biti
skraćen na pet aminokiselinskih ostataka sa potpunim očuvanjem selektivnosti
vezivanja sa receptorom. Sličan problem je predstavljao i praktično
je rešen za peptidni hormon eritropoetin. Hormon eritropoetin (MM
46000), promoviše proliferacije, diferencijacije i preživljavanja
ćelija-prethodnika eritrocita. U grupi peptida pronađeni su kratki
peptidi (14 aminokiselinskih ostataka), koji su pokazivali dejstvo
slično naslednom hormonu.
U isto vreme su identifikovani i
ispitani endogeni regulatorni peptidi čoveka, koji su pokazali specifične
aktivnosti tkiva, kada se koriste u veoma malim koncentracijama.
Studija produkata hidrolize hemoglobina i peptida, sadržanih u hranljivoj
sredini tokom kultivacije ljudskih crvenih krvnih zrnaca, pokazalo
je da kratki segmenati lanaca globina su aktivni, neuobičajeno za
početni hemoglobin: oni se vezuju za opijatne receptore, potenciraju
delovanje bradikinina. Regulatorni peptidi su takođe izolovani iz
žive kulture ćelija koštane srži, ispitane u pogledu posebne regulatorne
aktivnosti i nazvani su mielopeptidima.
Nedavno je i eksperimentima dokazala
da prirodni peptidni preparati, kao i njihovi sintetski analozi
- tetrapeptidi specifične strukture - pokazuju specifične delatnosti
tkiva, učestvuju u aktiviranju hromatina i normalizaciju ritam sinteze
proteina u kulturi tkiva i na nivou organizama. Može se pretpostaviti
da kratki peptidi, koji podržavaju autokrinu regulaciju, postaju
mimetici i agonisti visokomolekularnih transkripcionih faktora.
Mehanizmi penetracije kratkih peptida
u ćeliju i ćelijaski nukleus mogu biti različiti. Prema I.P.Ašmarinu,
mehanizam prodora neuropeptida u ćeliji i gene neurona je sličan
mehanizmu prodora steroidnih hormona. Više hidrofilnih kratkih peptida,
za razliku od steroidnih hormona, za savladivanje membrane lipida
vezuju se sa hidrofilnim grupama fosfolipida na spoljašnjoj strani
membrane, grupišu se i ulaze u ćeliju, koristeći mehanizam sličan
pinocitozi. Formiranje kompleksa "protein-protein" i njihovo
razdvajanje – opšti je mehanizam unutarćelijskih transportnih procesa.
U citoplazmi se nalaze receptori steroida, koji su u strukturi "C4
cinkovi prst". U odsustvu steroidnih hormona taj receptor je
povezan sa proteinima HSP 90 (heat stock protein), koji je uvek
prisutan u citoplazmi. Pri pojavi steroidnog hormona, taj neaktivni
kompleks se razbija, i steroidni hormon se vezuje za receptor, formirajući
aktivni kompleks, koji se prenosi do jedra, gde se vezuje za regulatorni
deo celog gena i aktivira (ili potiskuje) njegovu transkripciju.
Moderni pogledi na propustljivost
citoplazmi i nukleidne membrane pokazuju da penetracija kroz ove
membrane i difuzione puteve postoji.
Pored ranije poznatih jonskih kanala
i procesa pinocitoza, bili su otkriveni kanali, formirani familijom
transmembranskih porins proteina, prisutnih u mitohondriji i citoplazmi
membrane. Ovi proteini sadrže do 50% hidrofilnih aminokiselina i
strukturnih motiva amfifilne a-spirale. Medutim, većina peptidnih
lanaca nalazi se u p-usaglašenosti. Nekoliko transmembranskih porins
lanaca obrazuju pore bacvastog oblika (barrel-shaped), koje su porozne
za male hidrofilne i amfifilne molekule (urea, glicerol, triptofan,
itd.). Na primer, pri razlici u koncentracijama triptofana 0.001
M, njegov difuzioni protok kroz membranu je 600 molekula po sekundi
na 1 µm2 površine membrane.
Grupa porinsa uključuje podgrupe
akvaporinsa - proteine koji kontrolišu protok vode u ćeliju i iz
ćelije u skladu sa malim promenama u pH okoline.
Nukleidne membrane takođe imaju
razvijen sistem transportnih pora, formiranih proteinskim kompleksima
- nukleoporama koje kontrolišu saobraćaj nukleoproteinskih kompleksa
u jezgro i iz jezgra. Unutrašnji prečnik nukleopora je reda 42 nm,
tako da propuštaju molekule sa molekulskom masom od 5000 Da.
Dakle, mogućnost prodiranja kratkih
peptida u ćeliju i jezgro ćelije ne izaziva nikakve suštinske sumnje.
Naše eksperimentalne studije su u skladu sa pretpostavkom penetracije
kratkih peptida u ćeliju i njeno jezgro, jer ubacivanjem peptida
u strukturu ćelije izaziva promene u sastavu hromatina. U literaturi
je bilo dokazano, da u ćelijama u strukturi tkiva, kratki sintetički
peptidi ne samo da uđu u celiju, kroz citoplazmu i nukleidne membrane,
već i učestvuju u aktiviranju pojedinih gena, naročito gene telomeraze.
Proučavanjem, otkriveno je dejstvo
kratkih sintetičkih peptida na promene heterohromatina u leukocitima
i aktiviranje ribozomalnih gena, dekondenzacija gusto zbijenih vlakana
hromatina, kao i oslobadanje gena, utisnutih u rezultate starosne
kondenzacije euhromatizovanih delova celija.
Međutim, do danas postoji očigledne
razlike između brojnih zapažanja regulatornih dejstava neurohormona
i sintetičkih oligopeptida na stanje hromatina i koncepta molekularnih
mehanizma selektivnog vezivanja ovih peptida sa početnim delovima
gena.
Među kratkim sintetičkim peptidima,
prethodno ispitanih u pogledu aktiviranja hromatina, najefikasniji
se pokazao sintetički tetrapeptid epifize (Ala-Glu-Asp-Gly). Ovaj
peptid je, takođe, od posebnog značaja, jer pokazuje visoke geroprotektivne
aktivnosti. Istraživane su strukturne karakteristike ovog peptida
kako bi se pronašle sličnosti između parametara, specifične za ove
peptide, na koje utiču aminokiseline i nukleotidi u strukturi dvostruke
spirale DNK. Predlože se model specifičnog vezivanja peptida na
bazi prepoznavanja sa početnim delovima gena, izgrađenih na principu
geometrijske i elektrohemijske komplementarnsti dva pravospiralna
molekula - peptida i dvostruke spirale DNK.
Osnove dopunskih
interakcija u
sistemu "oligopeptid - oligonukleotid"
Cilj našeg istraživanja bio je u
pronalaženju mogućeg mehanizma za selektivno prepoznavanje i vezivanje
kratkih peptida sa delom genetskog aparata, koji je odgovoran za
pokretanje sinteze proteina.
Mehanizam prepoznavanja u sistemu
"peptid - DNK" po principu "jedna aminokiselina -
jedan par nukleotida" ne može biti specifičan. Od 20 aminokiselina
najmanje 8 može istovremeno da komunicira sa funkcionalnim grupama
dva susedna bazna para, jer su prilično dugi i kreću se po površinama
funkcionalnih grupa. Medutim, selektivnost takvih veza je nizak.
Aminokiseline sa aromaticnim bočnim grupama mogu se vezati za dvostruke
spirale DNK, kao rezultat interakcije aromatičnog prstena aminokiseline
i nukleotida.
Veća selektivnost (izbor) prepoznavanja
i povezivanja obezbeđuje mnogobrojnu ko-operativnu interakciju u
sistemu "oligopeptid - oligonukleotid".
Molekularno prepoznavanje u oblasti
biologije je zasnovan na tačnom odnosu molekularnih površina interakcijskih
molekula i slučajnosti dimenzionih parametara rasprostranjenih na
toj površini interakcijskih funkcionalnih grupa. Strukturne veze
ove vrste nazivaju se matričom komplementarnosti.
Peptidni lanac koji se sastoji od
L-izomera može imati više sastava. Konkretno, R-strukturni oblici
peptidnih lanca imaju najčešće izduženi oblik i odnose se na proširenu
vrstu peptidnih sastava, u kojim je udaljenost izmedu aminokiselinskih
ostataka jednako. Ovaj oblik obezbeđuje dovoljnu slobodu bočnih
grupa i omogućava im da izvrše najveći broj medumolekularih interakcija.
Orijentacija bočnih grupa aminokiselinskih ostataka zavisi od mogućnosti
medumolekularne interakcije sa drugim makromolekulima ili sa komponentama
životne sredine.

Slika 1.
Ortogonalna projekcija proširenog sastava peptida Ala-Glu-Asp-Gly
(projekcija na površinu). Prikazene su krajnje i bočne funkcionalne
grupe, sposobne za dopunske interakcije sa DNK.
Zadebljana linija označava osnovni
peptidni lanac. Atomi osnovnog peptidnog okvira nisu označeni, atomi
vodonika i kiseonika, koji pripadaju površini peptidne veze, nisu
prikazani:
- NH3 - proton donorne grupe,
- O - proton akceptorne grupe,
- CH3 - hidrofobna (metalna) grupa.
U izgradnji modela matrice komplementarnosti
tetrapeptida sa odgovarajućim učešćem dvostruke spirale DNK korišćeni
su objavljivani podaci o geometrijskim karakteristikama dvostruke
spirale DNK i peptidnog lanca i obrasci interakcije DNK sa poliamfolitamima.
U konkretnom slucaju u studiji karakteristika
sastava tetrapeptida Ala-Glu-Asp-Gli pronađeno je, da eneretski
najpovoljna usaglašenost u vodenom rastvoru (homogeno okruženje)
ima maksimalnu dužinu od 5.15 A, maksimalnu širinu od 8,5 A. U fiziološkim
uslovima, odnosno, u neutralnom okruženju pH u rastvoru neskomolekularnih
elektrolita i pri mnogobrojnim interakcijama sa DNK, koji određuju
distance između nukleotidnih parova, ovaj tetrapeptid ima izduženi
oblik proširene r-strukture sa transkonfiguracijskim rasporedom
bočnih grupa tih ostataka.
Očigledno, kao rezultat međusobnog
odbijanja između susednih negativno naelektri-sanih bočnih grupa
ostatka glutaminske i asparaginske kiseline i granične karboksil-ne
grupe, njihova usaglašenost će biti energetski povoljna.
Nukleotidni parovi dvostruke spirale
DNK u aktivnom hromatinu rasporedeni su jedan nad drugim, gotovo
u paralelnoj ravni. Na jednu zavojnicu dvostruke spirale DNK dolazi
10 baznih parova, prosečno rastojanje između ravni baznih parova
je 3,4 A. Poznato je, da fosfodiesterna osnova lanca deli poprečni
presek dvostruke spirale DNK na dva nejednaka dela. U tom smislu,
na molekularnoj površini dvostruke spirale DNK razlikujemo veći
i manji kanal širine od 22,2 A i 11,8 A, odvojene sa dva fosfodiesterna
lanaca.
Na slici je prikazana ortogonalna
projekcija na ravan stranica r-usaglašenosti tetrapeptida Ala-Giu-Asp-Gli.
Ovaj tetrapeptid sa prilično glomazanim bočnim grupama, samo u većem
kanalu dvostruke spirale DNK je u interakciji sa funkcionalnim grupama,
koje su izložene na površini tog kanala nukleotidnim parovima dvostruke
spirale. Interakcija peptida sa manjim kanalom dvostruke spirale
je energetski nepovoljan zbog međusobnog odbijanja fosfatnih grupa
DNK i karboksilnih grupa peptida.
Dakle, dvostruka spirala DNK i peptidni
lanac imaju određene dimenzije: dužina peptidnog lanca u r-usaglašenosti,
pripisuje se velicini jedne aminokiseline, i iznosi 3,47 A, a rastojanje
između baznih parova u DNK lanca jednaka je 3,4 A. Pošto oba učesnika
u interakciji imaju pravospiralnu orijentaciju glavnih lanaca, to
peptid, bez daljeg stresa, može se postaviti u veliki kanal DNK.
To dovodi do mnogobrojnih međumolekularnih interakcija peptida i
DNK, uključujući polarne i hidrofobne grupe oba učesnika.
Kada tražite nizove nukleotidnih
parova, komplementarnih ovom tetrapeptidu, po rasporedu proton-donatora,
proton-akceptora i hidrofobnih grupa, uzimaju se u obzir strukturne
karakteristike lokacije nukleotidnih parova na površini velikog
kanala DNK, podatke o interakcijama između parova aminokiselina
i peptida sa nukleinskim osnovama i ocena elektrostatičkog potencijala
površina DNK. U isto vreme igraju ulogu orijentacijione interakcije
peptida sa nukleinskim osnovama.
Najviše polaznih (nekodiranih) delova
gena sadrže u lanacima mnogobrojna ponavljanja relativno kratkih
sekvenci (nukleotidnih jedinica). Dužina takvih blokova obično je
6-10 baznih parova (bp), odnosno, manje od jednog zavoja dvostruke
spirale. U strukturi transkripcionih faktora i regulatornih peptida
su, takođe, sadržane ponavljajuće sekvence aminokiselina, koje se
obično sastoje od 5-6 aminokiselinskih ostataka (AO dalje) u peptidnom
bloku. Pretpostavljamo da ponavljanje nukleotidnih blokova na početnim
delovima gena su mesta selektivnog vezivanja za peptidne blokove,
koji se vraćaju u sastav regulatornih peptida. Regulatorni peptid
i određena sekvenca nukleotida DNK znaju jedni druge u slučajevima
u kojima aminokiselinska sekvenca na dovoljnoj dužini lanca dopunski
određuje raspored funkcionalnih grupa nukleotidnih jedinica u velikom
kanalu dvojne spirale DNK.
Dimenzione karakteristike lokacije
funkcionalnih grupa pojedinačnih nukleotidnih parova, koji su na
površini velikog kanala dvostruke spirale DNK pri objedinjavanju
nukleotidnih parova u opštu strukturu, određuju potencijal molekularne
površine velikog kanala. Jasno, svaka jedinica nukleotidnih parova
eksponira na površinu velikog kanala DNK svoju jedinstvenu osobinu
funkcionalnih grupa. Ove grupe mogu da učestvuju u vodoničkim, jonskim
vezama i hidrofobnim interakcijama sa peptidnim lancima, ako je
lokacija bočnih grupa peptida dopunski odgovara tim osobinama.
Model dopunske
interakcije tetrapeptida
Ala-Giu-Asp-Gli (AEDG) sa dvostrukom spiralom DNK
Za naše istraživanje smo odabrali
grupu visokomolekularnih faktora transkripcije, koje imaju karakteristike
"spirala-petlja-spirala", strukture koje su detaljno izučene.
Mnoge od njih su uključene u pokretanje transkripcije vitalnih gena:
telomeraze i RNK polimeraze II. Poznato je da deo petlje ovih proteina
se sastoji od 14 ostataka, uglavnom asparaginske, glutaminske aminokiseline
i treonina. Proučili smo sintetički peptid koji je kvalitativno
sličan ovoj petlji, po odnosu hidrofilnih i hidrofobnih grupa.
Međumolekularna interakcija između peptida AEDG i DNK sprovodi se
u obliku vodoničnih veza između funkcionalnih grupa oba učesnika.
Dužina vodonične veze u ovim sistemima obično iznosi 2.0-2.5 A,
odnosno, veća je od polovine rastojanja između površina uparenih
osnovnom dvojnom spiralom. Preredospodela nukleotidnih parova bila
je određena njihovom sekvencom ATTTS, koja je komplementarna tetrapeltidu
AEDG.
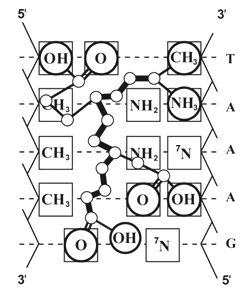
Slika 2.
Ortogonalna projekcija modela dopunske veze
tetrapeptida Ala-Giu-Asp-Gli sa dvostrukom spiralom DNK
Pri izgradnji modela dopunskih medumolekularnih
veza tetrapeptida sa DNK uzima se u obzir dužina kovalentnih veza
1.5 A, jon-jonske veze 2,5 A i vodonična veza 2.0-2.5 A. Mogućnost
promene uglova nagiba površina nukleotidnih parova, u odnosu na
osu dvostruke spirale, nisu razmatrane.
Na slici je ortogonalna projekcija
peptida, u kombinaciji sa jedinicom nukleotidnih parova dvostruke
spirale DNK. Prikazano je, kako je tetrapeptid AEDG razmešten u
velikom kanalu dvostruke spirale DNK, u skladu sa zahtevima komplementarnosti
funkcionalnih grupa tog tetrapeptida sa funkcionalnim grupama nukleotidnih
parova. Specificnost predloženog modela je činjenica, da je peptid
u velikom kanalu istovremeno u interakciji sa osnovama funkcionalnih
grupa obeju lanaca dvojne spirale DNK.
Treba napomenuti, da je sličan raspored
funkcionalnih grupa na površini velikog kanala dvojne spirale za
nukleotidne parove A - T i G - C, visoka mobilnost funkcionalnih
grupa, krajnjih aminokiselinskih ostataka alanina i glicina, kao
i varijabilnost ugao nagiba ravni nukleotidnih parova u odnosu na
osu dvojne spirale koji dozvoljava tetrapeptidu AEDG dopunsku vezu
sa sekvencama ATTTG, GTTTC, STTTS, iako će snaga ovih veza biti
slabija, nego sa ATTTS.
Kao što je već pomenuto, tetrapeptid
AEDG je od posebnog značaja zbog svoje visoke geroprotektorske efikasnosti.
U eksperimentima na životinjama, pokazuje značajan uticaj na povećanje
očekivanog životnog veka i sprečavanje procesa maligne transformacije
tkiva. Postoji hipoteza da je ukupna dužina vremena postojanja ćelijskih
populacija u korelaciji sa dužinom telomera hromozoma, a time i
aktivnost enzima telomeraze. U procesu ćelijske proliferacije smanjuje
se broj ponavljanja TTAGGG na krajnjim delovima hromozoma, zbog
problema sa replikacijom. To stalno skraćivanje se može prevazići
ako ćelija ima dovoljno visok nivo aktivne telomeraze. Većina normalnih
somatskih ćelija nemaju aktivne telomeraze, i skraćenje telomera
završava se gubitkom vitalnosti takvih ćelija.
Koristeci podatke iz literature,
otkrili smo da redosled nukleotida ATTTS, određuje sa modelom dopunskih
interakcija peptid – DNK, koji se nalazi 9 puta u sastavu početnog
dela telomeraze gena (na intervalu 3729 bp od početka transkripcije).
Očigledno, dopunske interakcija peptida AEDG sa jedinicama ATTTS
može da dovede do reaktiviranja telomeraznog promotera u somatske
celije, koje iniciraju unutarćelijsku sintezu telomeraze, istezanje
telomera, povećanje proliferativnog potencijala tkiva, i na taj
način može značajno uticati na životni vek.
Specificni gen, koji se nalazi u
subtelomernoj oblasti takođe sadrži blok ATTTS u sastavu svog početnog
dela i može da posluži kao osnova povezivanja sintetičkog tetrapeptida
epifize.
Jedan od uzroka starenja je usporavanje
sinteze proteina. Transkripcija svih proteinskih gena prenosi se
enzimom DNK – zavisne RNK polimeraze II, nakon pokretanja ovog procesa
faktorima transkripcije. Biosinteza RNK polimeraze II, takođe, ne
može biti sproveden bez pokretanja transkripcije odgovarajucim FT.
Ranije u literaturi je objavljeno, da je blok ATTTGCAT jedan od
mesta povezivanja FT RNK polimeraze II. Na početnom delu gena velike
subjedinice RNK polimeraze II niz ATTTS sreće se 3 puta na vodećem
lancu, i 5 puta na sastavu lanaca (antiparalelni), a niz ATTTG -
6 puta.
U tekućoj literaturi, može se pronaći
značajan broj publikacija o regulatornom dejstvu kratkih peptida.
Razlika između visokomolekularnim faktorima transkripcije i kratakih
peptida, koji su uključeni u pokretanje transkripcije gena, se manifestuju
pre svega u procesima transporta ovih molekula, iz okoline u jezgra
ćelija. Pored toga, kratki peptidi su tkivno specifični, ali nisu
po vrstama specifični i ne pokazuju imunogenost.
Naši predloženi modeli molekularne
interakcije kratkih peptida sa dvostrukim spiralama DNK na početnom
delu gena zaslužuje eksperimentalnu verifikaciju na nivou fizičko-hemijskih
istraživanja sintetičkog sistema "oligopeptid - oligonukleotid".
Zaključci:
Strukture peptida i dvostruke
spirale DNK obezbeduju uslove za prepoznavanje i dopunsko povezivanje
peptida za određenu jedinicu nukleotida u funkcionalnim grupama
na površini velikog kanala dvostruke spirale DNK u oblasti početnog
dela gena. U povezivanju učestvuju oba lanca dvostruke spirale
DNK. Predložene metode molekularnog modelovanja dopunskog povezivanja
peptida na početnom delu gena može biti korisno za pronalaženje
potencijalno aktivnih kratkih peptida – mimetici faktora transkripcije
– prema redosledu nukleotida na početnom delu celokupnog gena.
Literatura:
1. Havinson V.H., Šateva L.K.:
Model dopunske interakcije kratkih peptida sa dvostrukom spiralom
DNK, Med. akad. casopis, 2005. T. 5, No 1, S. 15-23, Sankt-Peterburgški
Institut za bioregulaciju i gerontologiju SZO RAMH, Institut za
makromolekularna jedinjenja RAN, Sankt-Peterburg.
<
NA VRH >
TAJNA ŽIVOTA – NANOPEPTID
Stručnjaci tvrde da je trajanje života
homo sapiensa 100-120 godina. Zašto onda tako malo ljudi danas doživi
te godine? Kakvi naučni pronalasci vode dugačkom životu? Šta su
kratki peptidi i da li se tajna života nalazi u tim nanopeptidima?
Vladimir N. Anisimov, predsednik Gerontološkog Saveza kaže: "Kao
što to već znamo, čovečanstvo brzo stari. U zadnjih 160 godina očekivana
dužina života se svake godine smanjuje za tri meseca i nemamo razlog
za pretpostavku kako će se taj proces promeniti. Istovrenano u zadnjoj
deceniji podaci pokazuju popravak tendencije, u Sjedinjenim Državama
naprimer, gde očekuju da će više nego pola miliona ljudi doživeti
stotu godinu”.
Jedna od mogućnosti je – najaktivnija
oblast istarživanja ruskih naučnika - razvijanje peptidnih lekova.
Istraživanje je trajalo više nego 35 godina i to u najčuvenijim
ruskim institutima: u Sankt Peterburgu, Moskvi, Novosibirsku i drugim
gradovima.
Puno eksperimanta je vršeno lekovima
i najčešće (više nego 30 eksperimenata) ispituju njihovo dejstvo
na produženje života. Utvrđeno je da ovi lekovi smanjuju broj oboljenja
i usporavaju proces starenja. Naučnici su izneli svoj program u
oblasti prevencije protiv preranog starenja.
Vladimir Nikolajevic Shabalin, direktor
Gerontološkog Instituta MŽR, akademik, profesor:
Gerontologija, gerijatrija – postoji više teorija u istraživanju
procesa starenja. Najvažnija oblast našeg istraživanja je biološki
proces ljudskog života. Tokom dvadesetog veka se očekivan rok trajanja
života skoro udvostrucio. U kameno doba su ljudi živeli prosečno
25 godina, u srednjem veku 30-35 godina, dok krajem XX veka već
70 godina.
U ovo doba je čovecanstvo postiglo
neki nivo intelektualnog razvoja. Muškarci su počeli da se umešaju
u biološki proces života, probali su da žive što je duže moguće.
Postoje tri glavna faktora koji omogućuju prevenciju protiv patološkog
starenja:
1. hemijski faktor – reguliše
neke degeneracije
2. fizički faktor – uticaj sekundarnih procesa na organizam
3. biološki faktor – uticaj preventivnih elementa na proces starenja
Bioregulatori su jako važni za intelektualni
razvoj, oni mogu da omoguće ostvarenje naših zahteva i želja.
Vladimir Khatskelevic Khavinson,
potpredsednik Gerontološkog Saveza, direktor Bioregulativnog i Gerontološkog
Instituta Univerziteta u Sankt Peterburgu i dopisni član Gerontološkog
Instituta, RAM kaže:
"Danas prezentujemo istaknuti učinak, metode i tehnike na svetskom
nivou koji igraju znatnu ulogu u prevenciji protiv preranog starenja.
Ovaj program je efikasan i uspešan u Rusiji."
Rezultati dugotrajnih istraživanja
u Bioregulativnom i Gerontološkom Institutu Univerziteta u Sankt
Peterburgu su pokazali da kratki peptidi i 2-3-4 aminokiseline,
koje se sastoje od peptidnih bioregulatora, regulišu metabolizam
i tako nam omogućuju da telo funkcioniše na način kao što to radi
mlad i zdrav organizam. Ovako se regeneriše biološko i funkcionalno
aktivno habanje kao i nezdrave ćelije i nezdrava tkiva.
Nanopeptid je temelj jednog novog
skupa lekova, a to je kompleks peptidnih bioregulatora. Svi eksperimenti
potvrđuju da peptidi efketivno utiču na proces starenja.
Ovo je princip delovanja aktivizacionog
metabolizma na kompleksnom temelju u ljudskom organizmu i ćelijama.
Utiče na nanopeptidnu–kratki lanci 2-3-4 aminokiseline – sekvenciju
koja je zapravo jedan ugrađeni informacioni kod, pa ćelije započinju
aktivnu sintezu sa belančevinama. Ovaj mehanizam je univerzalni
ključ, on se promenom godinama i sam menja pošto je poznato: što
je starija ćelija, to sve teže sintetizuje belančevine. Peptidi
su bezopasni pošto su aminokiseline i prirodno prisutne u organizmu.
Popravljaju proces metabolizma, popravljaju ćelije a tkiva i organi
pomoću njih imaju karakteristike mladog organizma.
Protekom godina smo naučili kako
da izaberemo peptide za raznovrsne tipove tkiva: kosti, hrskavice,
mišici, vaskularni sistem, itd. Naprimer peptidi corpus pineale
(deo mozga) kod čoveka stvaraju odgovarajući ritam za proizvodnju
melatonina sa strane hormona koji sprečava starenje. Noćni posao
je veoma štetan pošto se melatonin stvara samo noću i to za vreme
spavanja. Onaj koji noću radi, brže stari.
Institut je od životinjskih i sintetizovanih
repromaterijala razvio nekoliko desetina nanolekar-a ali nažalost
oni će se u apotekama širom sveta pojaviti tek posle nekoliko godina.
Biološki znaci starenja
 |
Biološko
starenje (involutivne i degenerativne promene) nastaju na molekularnom
nivou zbog poremećaja sinteze specificnih belančevina i promena
na nivou gena što dovodi do promene strukture tkiva i organa.
Ove strukturne promene dovode do gubitka funkcije organa i pojave
znaka starenja organizma (od hroničnih obolenja, fizičkih znaka
starenja kože i fizičkog spoljneg aspekta) do smrti kao finalnog
procesa starenja. Biološko starenje se sinhrono događa na svim
sistemima humanog i organima humanog organizma: |
Involutivne
promene na timusu počinju već u prvoj godini života i tokom života
dovode do imunodeficijencije (poremećaj imunog odgovora) što rezultira
pojavom sniženog imuniteta, malignih obolenja i izmenom (sniženje)
otpornosti ka infekciji.
Involutivne
promene na epifizi dovode do sniženja sinteze melatonina, hormona
koji ima udaljene efekte na ceo organizam (promena bioritma, nesanica,
sniženje imuniteta, reproduktivnih funkcija i sklonosti ka kancerogenim
obolenjima).
Promene
na koštano-zglobnom sistemu dovode degenerativnih obolenja kostiju
i osteoporoze.
Promene
u hematopoeznom i kardiovaskularnom sistemu odnose se pre svega
na promenu eritropoeze i sklonosti ka trombozama, embolijama, moždanim
insultima, razvoju koronarne ateroskleroze i povećanjem rizika od
pojave infarkta miokarda,
ali i hipertenzije.
Promene
funkcija respiratornih organa zasnivaju se na promeni strukture
kapilara i elastičnosti vlakana na nivou alveola i smanjenju funkcije
ventilacije pluća, razvoju emfizema i respiratorne insuficijencije.
Involutivne
promene organa za varenje evidentne su pre svega u usporavanju regeneracije
sluznice i smanjenju tonusa tankog creva, što dovodi do funkcionalnih
poremećaja varenja hrane. Starenjem se menja funkcija jetre, smanjuje
protelitička, lipolitička i amilolitička aktivnost pankreasa. Povećava
se sklonost ka stvaranju žučnih kamenaca zbog zastoja žuči, a snižava
se peristaltika, motorna i sekretorna funkcija digestivnog trakta.
Involutivne
promene na urogenitalnom sistemu manifestuju se snižavanjem klirensa
kreatinina i uree, kod muškaraca se razvija adenom prostate, zbog
gubitka elastičnosti zidova mokrćne bešike dolazi do učestalih urinarnih
infekcija i inkontinencije urina.
Biološko
starenje kože i njenih derivata pretstavlja vizuelno najdramaticniji
aspekt starenja organizma. Koža gubi tonus, pojavljuju se bore,
hiperpigmentacije i keratoze. Kosa gubi prirodni pigment, postaje
seda, proređuje se, a nokti postaju krti, gube prozračnost i uobičajenu
strukturu.
Starenjem
reproduktivnih organa kod oba pola dovodi do dramatičnih psihofizickih
promena. Kod muškaraca se posle 50 godine smanjuje spermatogeneza,
snižava nivo testosterone u cirkulaciji što dovodi do gubitka libida
i često do impotencije. Glavni razlog impotencije u starijoj dobi
lezi u razvoju aterosklerotičnih promena na arterijama i promena
građe venskog sistema polnih organa. Andropauza ima značajne negativne
efekte na ukupno psihičko zdravlje muškarca i razvoj depresije.
Kod ženskog pola, nakon 50-te godine nastaje klimakterijum (ekvivalent
andropauzi), menja se hormonski status što dovodi do atrofičkih
promena na sluznici genitalnog trakta. Psihički se manifestuje promenama
raspolozenja, čestom razdrazljivošću i depresijom.
Biološkim
starenjem endokrinog sistema nastaju promene u lučenju hormona kod
oba pola i mnogobrojni efekti na organizam, najčešce poremecaj glikoregulacije
i nastanak dijabetes melitusa.
Biološko
starenje čulnih organa: s godinama se značajno degenertaivno menjaju
strukture organa sluha i vida što rezultira gubitkom sluha u većoj
ili manjoj meri.
Na organima vida menja se oštrina vida i sposobnost akomodacije,
razvija se katarakta, glaukom, degeneracija makule retine. Senzorni
organi starenjem gube svoje osnovne funkcije: menja se čulo ukusa,
mirisa, smanjuju se sposobnosti taktilne i somatske osetljivosti.
U starijoj
životnoj dobi struktura ćelija nervnog sistema se menja tako što
dolazi do degenerativnih obolenja (Parkinsonova bolest, Alzhajmer,
demencija, slabija memorija). Značajne su izmene u sferi psihičkih
promena i promena karaktera: smanjenje tolerancije, adaptacije na
promene u socijalnom okruzenju, sklonost ka agresivnom ili depresivnom
raspolozenja. Razvojem senilnosti, snižavaju se intelektualne sposobnosti
do personalnih promena kao što su nesposobnost pisanja, čitanja
i pamćenja.
Psihološke karakteristike starenja
Biološka
starost, ma kako bila neminovna, dovodi do ozbiljnih personalnih
promena individue i često do gubitka intelektualnih funkcija i generalno
samopouzdanja. Promene su u u oblasti emotivne sfere (osećaj razočaranja
i negativnog životnog bilansa, usamljivanje i gubitak socijalnog
statusa), gubitka fizičke privlačnosti i često teških gubitaka autoriteta
u porodici ili okolini. Menja se sfera interesovanja, akcenat se
prenosi na sopstveni unutrašnji svet, smanjuje se kontrola nad sopstvenim
reakcijama, javlja se otpor ka promenama, strah od smrti. Donose
se često negativni životni bilansi, koji vode ka osećanju depresije
sa suicidalnim idejama.
Psihološke
karakteristike starenja, kao prateći segment biološkog starenja
su poseban segment regenerativne medicine i razvoja procedura i
preparata koji bi trebalo odloži biološko starenje.
Koji
je mehanizam dejstva peptidnih bioregulatora u ubrzanju procesa
regeneracije na ćelijskom nivou?
Svaka
ćelija organizma sastoji se od jedra i mitohondrija uz veliki broj
drugih elemenata. U jedru je genetski zapis – informacija, zadužena
za sve fundamentalne procese tokom čitavog života čoveka.
DNK,
nosilac svih naslednih faktora, tokom života trpi određene promene.
Na primer negativni faktori koji deluju na organizam čoveka dovode
do udvajanja DNK i niza reakcija koji se odražavaju na sintezu ćelijskih
belančevina, narušava se proces stvaranja, razvoja i regeneracije
ćelija. Nastaje "začaran krug". Upravo to je bio motiv
naučnika da razvije metodu dejstva na regulaciju sinteze belančevina
u celiji.
Peptidni
bioregulatori aktivišu DNK u ćeliji, za koju su specificni i štite
ćeliju svodeći na minimum negativne faktore koji je ugrožavaju.
Na taj način specificni kratki lanci peptida različitog sastava
aminokiselina imaju sposobnost ne samo zaštite DNK i strukture ćelije
nego i normalizuje i ubrzavaju proces regeneracije tkiva i organa
stimulišući unutrašnje rezerve tkiva i optimizacije svih osnovnih
funkcija organa u organizmu. Ovim se ne samo deluje profilaktički
i čuva zdravlje već i vraća biološki sat unazad!
Zahvaljujuci
dugogodišnjim istrazivanjima, eksperimentalnim i kliničkim, peptidni
bioregulatori su postali dostupni, njihova je efikasnost dokazana,
a bezbednost u potpunosti potvrđena. Tokom godina su više hiljada
ljudi, uspešno primenjujuci ove preparate sačuvali zdravlje i osećaju
se mladim u različitim starosnim dobima. Zahvaljujuci otsustvu kontraindikacija
i dostupnosti preparata bez recepta lekara, pojavio se nov način
ne samo osećati se zdravim već to i biti.
<
NA VRH >
|